纳米颗粒介导的靶向嵌合体正在改变靶向蛋白降解领域。 2026年1月20日,Nature Nanotechnology期刊发表了一篇题为 Nanoparticle-mediated targeting chimeras transform targeted protein degradation 的展望(Perspective)文章,首次提出纳米颗粒介导的靶向嵌合体(Nanoparticle-mediated Targeting Chimeras, NPTAC)概念,并系统总结且前瞻性分析了其如何重塑靶向蛋白降解(Targeted Protein Degradation, TPD)这一快速发展的前沿领域。文章作者包括河南大学刘洋博士、夏雪博士,华南理工大学张云娇教授,以及郑蒙教授、Kam W. Leong 教授、师冰洋教授,通讯作者为师冰洋教授、Kam W. Leong 教授和郑蒙教授。
NPTAC——重新审视纳米颗粒递送载体以外的纳米降解剂新角色
文章指出,近年来迅速崛起的相关研究表明,纳米颗粒不仅是被动的药物递送载体,其自身的细胞内运输过程及胞内命运,可被直接借用为靶向蛋白降解工具的一部分。随着以靶向蛋白降解嵌合体(Proteolysis-Targeting Chimeras)为代表的降解工具盒不断扩展,学界开始从靶向嵌合体的构造视角重新审视纳米颗粒:经靶向修饰的纳米颗粒,同样可以被抽象为纳米颗粒介导的靶向嵌合体(Nanoparticle-mediated Targeting Chimeras,NPTAC)。
在这一构造框架下,得益于纳米颗粒装配方式的高度灵活性,纳米降解剂的设计变得更加简便可行。通过配体修饰,纳米颗粒可被赋予捕获目标蛋白的能力,并进一步依托其天然的细胞运输路径,经自噬–溶酶体相关通路将目标蛋白引导至细胞蛋白回收站,从而实现对胞外蛋白、膜蛋白乃至胞内蛋白的高效降解。
这一研究方向的迅速发展,正在促使学界重新思考纳米颗粒设计的核心目标——纳米颗粒不再只是递送药物,在经过合理设计后,也可以成为主动参与蛋白稳态调控,从而显著拓展纳米材料在生物医学中的功能维度。
降解剂淘金热:领域正在发生的转向
作者指出,截至截稿时,围绕纳米颗粒介导的靶向蛋白降解领域,仍有大量高水平研究快速涌现,显示出该领域的高度活跃性,也为 TPD 技术与药物递送研究提供了新的交汇点和发展机遇。
文章系统梳理了降解剂的发展脉络,重点总结了 PROTAC、ATTEC、AUTOTAC、AUTAC、LYTAC、AbTAC、PROTAB 等代表性先驱降解工具的创新特点,同时指出,随着大量分子不断涌现,以 PROTAC 为代表的小分子降解剂赛道正逐步进入高度拥挤阶段。
在降解剂淘金热中,学界的关注重点正逐步从是否还能设计并合成出新的降解剂分子,转向靶点覆盖范围更广、是否具备体内组织特异性的问题,并进一步聚焦于回答这些工具在体内是否真正有效、是否具备可转化价值。
在这一背景下,降低劳动密集型合成负担、提升体内表现、实现组织与病灶层面的特异性,成为下一阶段降解剂技术必须回应的核心问题。
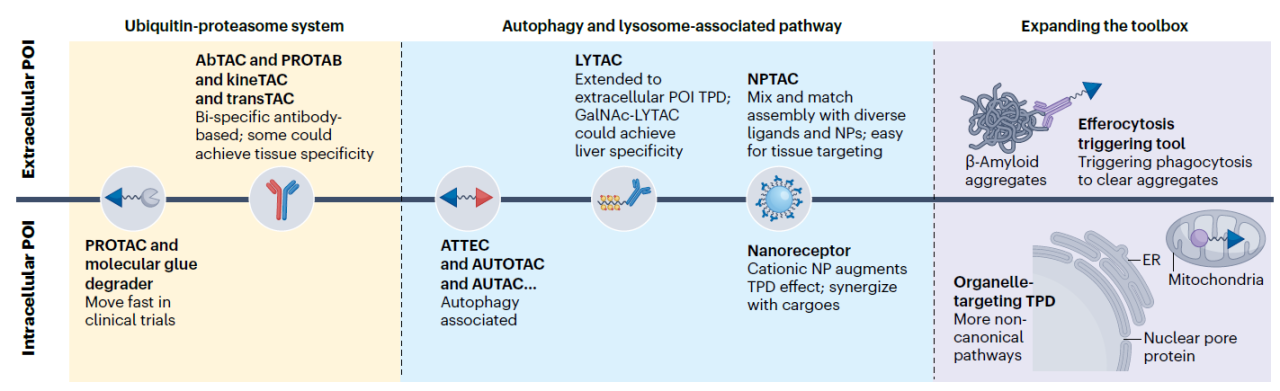
图1:靶向蛋白降解(TPD)工具的发展历程。从目标蛋白的亚细胞定位与降解通路两个维度系统梳理TPD工具的演进路径:早期以蛋白酶体途径为核心,随后拓展至自噬–溶酶体途径;降解对象也由胞内蛋白逐步延伸至胞外及膜蛋白。在此基础上,近年来不断涌现的非经典降解通路与非常规定位策略,正持续扩展TPD工具盒。
降解剂设计逻辑的再梳理:为何基于纳米颗粒介导的靶向嵌合体构造至关重要
文章进一步总结了通用意义上的降解剂设计最小元件:(1)目标蛋白识别抓手;(2)引导目标蛋白进入细胞蛋白降解 回收站的元件;(3)针对非细胞质蛋白,还需实现有效细胞内吞的引导元件。
在传统的小分子 TPD 工具中,这些功能要素通常需要通过高度定制化的分子模块分别实现,不仅合成复杂,即便获得结构设计漂亮的分子,其体内表现的系统优化仍往往任重道远。
而在纳米降解剂的设计架构下,纳米颗粒本体可同时承担回收站引导和内吞引导两项关键功能,目标蛋白的识别则通过表面配体实现。这一设计策略具有高度的灵活性与便捷性;同时,得益于纳米递送体系在体内循环、组织分布及临床应用方面的不断成熟,该框架下的纳米降解剂在体内行为调控与靶向设计方面具备天然优势。
这种纳米颗粒负责路径,配体负责识别的功能分工,使 NPTAC 具备高度模块化特征,其构建可通过即插即用(plug-and-play)方式实现,从而显著降低了降解剂设计与优化的整体门槛。
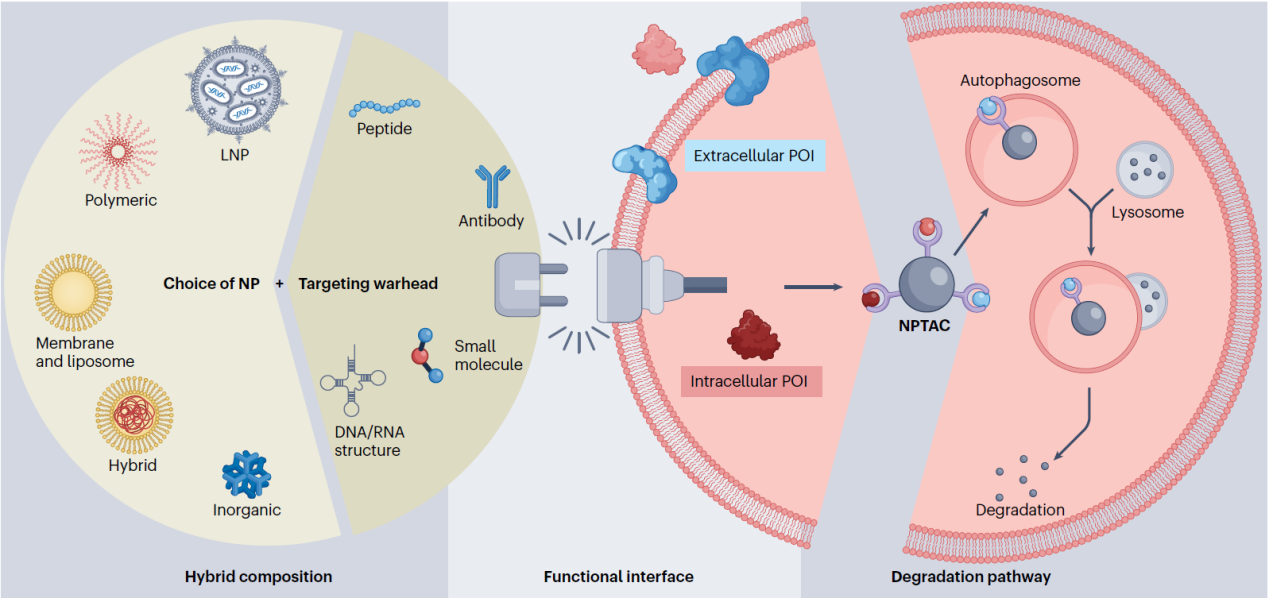
图2:纳米降解剂的模块化设计框架。从纳米颗粒介导的靶向嵌合体(NPTAC)视角审视纳米降解剂的设计逻辑:通过对纳米颗粒杂化组分、功能界面与降解通路的模块化组合,可实现高度灵活且便捷的纳米降解剂构建。纳米降解剂不仅降低了设计与制备复杂度,同时充分利用纳米递送体系在体内分布、组织富集与生物相容性方面的既有优势,为后续临床转化提供支撑。
直面转化挑战,思考多重权衡
与此同时,作者对临床转化保持了审慎而现实的判断。文章强调,在知识层面,将 TPD 功能引入纳米颗粒体系,本身就意味着对传统纳米递送用途的一次重要拓展;而在应用层面,仍需正视从实验室走向临床过程中必须做出的多重权衡。文中重点讨论了:在目标蛋白抓手设计中,亲和力强弱与尺寸位阻大小之间的取舍;在材料工程上,纳米颗粒结构复杂度与实际转化难度之间的平衡;以及在当前人工智能发展阶段,算法所提供的设计便利与其对真实体内疗效提升之间的实际收益评估。
在转化路径层面,作者提出可借鉴非均一体系抗体偶联药物(ADC)的临床审批经验,思考监管体系如何处理结构非均一性问题,从而为纳米颗粒靶向降解剂的设计、质量控制与临床推进提供现实参照。
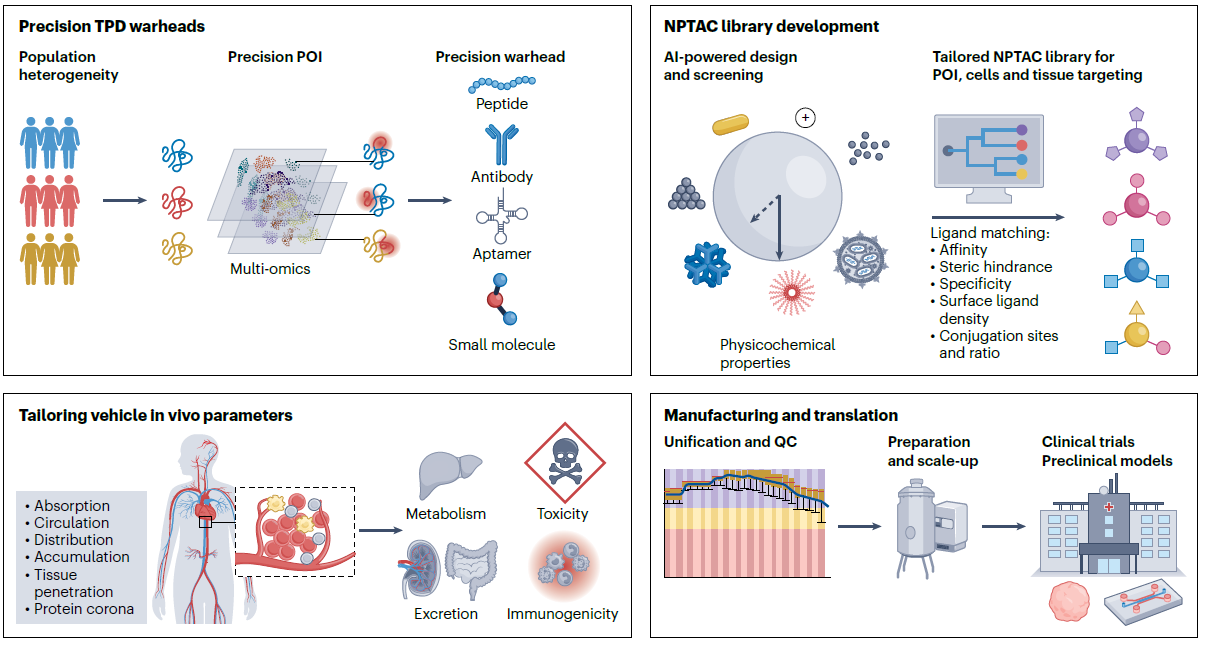
图3:NPTAC工具从实验室走向临床的潜力与挑战。患者异质性及目标蛋白(POI)的多样性,要求TPD平台均需进行高精度降解抓手设计。纳米降解剂通过灵活的组装模式,在无需大量从头合成的前提下,实现对不同 POI、组织及细胞类型的适配性靶向,辅以人工智能赋能的虚拟筛选,有望构建可快速调用的NPTAC库。纳米颗粒的理化性质以及配体参数(包括亲和力、尺寸位阻、特异性、表面配体密度与连接比例)对 TPD 效果具有关键影响。NPTAC 设计的高度灵活性,叠加纳米药物在药代动力学(PK)与药效动力学(PD)方面的优势,可能带来更优的体内疗效。为推进临床转化,仍需系统加深对纳米颗粒体内行为的理解,采用临床批准友好的敏捷制造与质量控制,避免过度工程化设计,建立可靠的验证模型是转化过程中的重点。
总体而言,这篇Nature Nanotechnology展望文章指出,NPTAC为靶向蛋白降解技术提供了一条不同于传统小分子竞赛的发展路径。随着纳米降解剂相关研究的持续升温,纳米颗粒与蛋白降解技术的深度融合,或将为精准治疗与新型药物模式带来新的可能性。通过充分利用纳米材料在体内递送、组织分布与胞内运输方面的既有优势,有望推动靶向蛋白降解从以合成为核心的劳动密集型路径,向平台化、以体内表现为导向的发展方向演进。文章重点强调了在通用纳米递送载体设计中引入可选的降解剂功能这一新的功能,可能代表着该领域一次重要的基础方法升级。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41565-025-02081-1
作者:师冰洋等 来源:《自然-纳米技术》

