研究开发靶向前列腺衰老的基因疗法。作为男性生殖系统的关键器官,前列腺衰老会引起前列腺液成分改变、影响精子活力,还会因组织增生导致尿道机械性梗阻及下尿路功能障碍。同时,生理性衰老伴随的功能退化,与良性前列腺增生及前列腺癌等高发疾病密切相关。目前,由于缺乏理想的动物模型与系统性研究策略,学界对其核心机制的认识有限,制约了有效干预手段的开发。
近期,中国科学院动物研究所研究团队等,解析了灵长类前列腺衰老的关键细胞与分子调控网络,揭示了基底上皮细胞中GRHL2-CDK19分子轴失活,可通过激活p53-p21信号通路,驱动前列腺衰老。基于该发现,团队进一步开发了靶向GRHL2的基因治疗策略,在动物模型中缓解了前列腺衰老相关表型,完成了从机制解析到干预策略的闭环研究。
团队系统比较了年轻食蟹猴与年老食蟹猴前列腺的外周区、移行区及中央区等不同解剖区域,并通过结合系统性组织学分析与高分辨率单核转录组学数据发现,这些区域存在共同的衰老特征。研究表明,上皮细胞衰老、慢性炎症及间质纤维化共同构成了灵长类前列腺生理性衰老的三大核心病理改变。这些结果提示,前列腺生理性衰老是具有整体性与退行性的过程,且会损害组织功能完整性。
同时,研究在机制层面发现,转录因子GRHL2在衰老前列腺的基底上皮细胞中表达明显下调,且这一现象在人类、非人灵长类及啮齿类等多个物种中高度保守,提示其或具有重要生物学功能。实验证实,GRHL2的转录失活,导致其靶基因CDK19表达下降,进而释放其互作蛋白p53,激活p21信号通路,最终驱动细胞衰老。GRHL2-CDK19-p53-p21信号轴的解析,为理解前列腺衰老的分子基础及开发干预策略提供了理论依据。
基于上述机制,研究团队进一步开发了靶向GRHL2的基因治疗策略。研究证实,向老年小鼠前列腺单次局部注射编码GRHL2的慢病毒载体,可提升GRHL2与CDK19的表达、延缓上皮细胞衰老。同时,该治疗可逆转组织分子衰老表型,并改善年龄相关的下尿路功能障碍,显示了其潜在的临床应用价值。
该成果系统阐明了人类和非人灵长类前列腺衰老的分子机制,为前列腺衰老及相关增龄性疾病防治提供了新靶点与新策略。
相关研究成果发表在《自然-衰老》(Nature Aging)上。
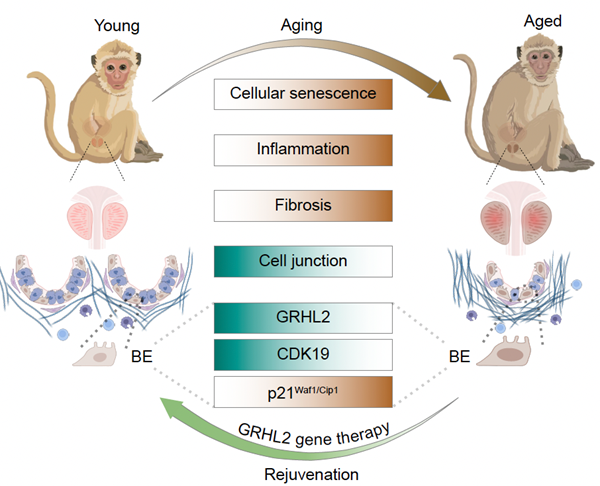
前列腺衰老机制及干预
研究团队单位:动物研究所

